Autors:
Bobbie Johnson
Radīšanas Datums:
10 Aprīlis 2021
Atjaunināšanas Datums:
1 Jūlijs 2024

Saturs
- Soļi
- 1. daļa no 2: Sagatavojiet aprīkojumu
- 2. daļa no 2: Veikt eksperimentu
- Padomi
- Brīdinājumi
- Ko tev vajag
Ūdens sadalīšanas process (H2O) tā sastāvdaļās (ūdeņradis un skābeklis), izmantojot elektrību, sauc par elektrolīzi. Gāzes, kas iegūtas elektrolīzes rezultātā, var izmantot patstāvīgi - piemēram, ūdeņradis kalpo kā viens no tīrākajiem enerģijas avotiem. Lai gan šī procesa nosaukums var šķist nedaudz gudrs, patiesībā tas ir vieglāk, nekā varētu šķist, ja jums ir atbilstošs aprīkojums, zināšanas un neliela pieredze.
Soļi
1. daļa no 2: Sagatavojiet aprīkojumu
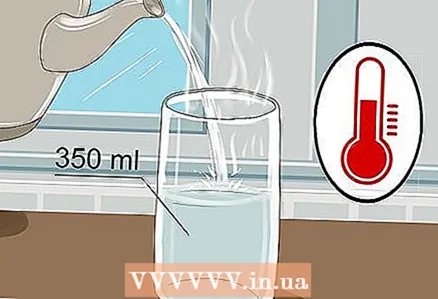 1 Paņemiet 350 ml glāzi un ielejiet tajā siltu ūdeni. Nav nepieciešams piepildīt glāzi līdz malām, pietiek tikai ar nelielu ūdens daudzumu. Auksts ūdens derēs, lai gan silts ūdens labāk vada elektrību.
1 Paņemiet 350 ml glāzi un ielejiet tajā siltu ūdeni. Nav nepieciešams piepildīt glāzi līdz malām, pietiek tikai ar nelielu ūdens daudzumu. Auksts ūdens derēs, lai gan silts ūdens labāk vada elektrību. - Derēs gan krāna ūdens, gan ūdens pudelēs.
- Siltam ūdenim ir zemāka viskozitāte, kas atvieglo jonu pārvietošanos.
 2 Ūdenī izšķīdina 1 ēdamkaroti (20 gramus) galda sāls. Ielejiet sāli glāzē un samaisiet ūdeni, lai tas izšķīst. Tas radīs sāls šķīdumu.
2 Ūdenī izšķīdina 1 ēdamkaroti (20 gramus) galda sāls. Ielejiet sāli glāzē un samaisiet ūdeni, lai tas izšķīst. Tas radīs sāls šķīdumu. - Nātrija hlorīds (t.i., galda sāls) ir elektrolīts, kas palielina ūdens elektrovadītspēju. Ūdens pats par sevi slikti vada elektrību.
- Pēc ūdens elektriskās vadītspējas palielināšanas akumulatora radītā strāva vieglāk izies cauri šķīdumam un efektīvāk sadalīs molekulas ūdeņradī un skābeklī.
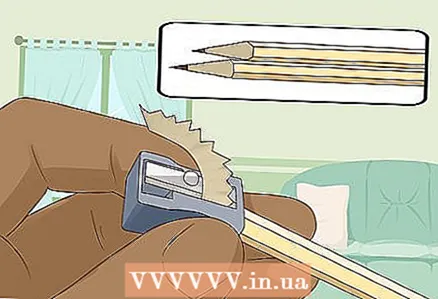 3 Asiniet divus grūti mīkstus zīmuļus abos galos, lai atklātu svinu. Neaizmirstiet noņemt dzēšgumiju no zīmuļiem. Abos galos vajadzētu izvirzīties grafīta stienim.
3 Asiniet divus grūti mīkstus zīmuļus abos galos, lai atklātu svinu. Neaizmirstiet noņemt dzēšgumiju no zīmuļiem. Abos galos vajadzētu izvirzīties grafīta stienim. - Grafīta stieņi kalpos kā izolēti elektrodi, pie kuriem pievienojat akumulatoru.
- Grafīts ir labi piemērots šim eksperimentam, jo tas nešķīst un nerūsē ūdenī.
 4 Izgrieziet pietiekami lielu kartona loksni, lai to varētu novietot uz stikla. Izmantojiet diezgan biezu kartona gabalu, kas nesaslīdēs pēc divu caurumu cauruma. Izgrieziet kvadrātveida gabalu no apavu kastes vai tamlīdzīgi.
4 Izgrieziet pietiekami lielu kartona loksni, lai to varētu novietot uz stikla. Izmantojiet diezgan biezu kartona gabalu, kas nesaslīdēs pēc divu caurumu cauruma. Izgrieziet kvadrātveida gabalu no apavu kastes vai tamlīdzīgi. - Kartonu izmanto zīmuļu turēšanai ūdenī, lai tie nepieskartos stikla malām un apakšai.
- Kartons ir nevadošs, tāpēc to var droši likt uz stikla.
 5 Izmantojiet zīmuļus, lai izurbtu divus caurumus kartonā. Ieduriet kartonu ar zīmuļiem - šajā gadījumā tie būs cieši saspiesti un neslīdēs. Pārliecinieties, ka grafīts nepieskaras stikla malām vai apakšai, pretējā gadījumā tas traucēs eksperimentam.
5 Izmantojiet zīmuļus, lai izurbtu divus caurumus kartonā. Ieduriet kartonu ar zīmuļiem - šajā gadījumā tie būs cieši saspiesti un neslīdēs. Pārliecinieties, ka grafīts nepieskaras stikla malām vai apakšai, pretējā gadījumā tas traucēs eksperimentam.
2. daļa no 2: Veikt eksperimentu
 1 Katram akumulatora spailim pievienojiet vienu vadu ar aligatora skavām. Akumulators kalpos kā elektriskās strāvas avots, un caur vadiem ar skavām un grafīta stieņiem strāva sasniegs ūdeni.Pievienojiet vienu vadu ar skavu pie pozitīvā, bet otru ar akumulatora negatīvo spaili.
1 Katram akumulatora spailim pievienojiet vienu vadu ar aligatora skavām. Akumulators kalpos kā elektriskās strāvas avots, un caur vadiem ar skavām un grafīta stieņiem strāva sasniegs ūdeni.Pievienojiet vienu vadu ar skavu pie pozitīvā, bet otru ar akumulatora negatīvo spaili. - Izmantojiet 6 voltu akumulatoru. Ja jums tāda nav, varat izmantot 9 voltu akumulatoru.
- Piemērotu akumulatoru var iegādāties elektrības piegādes veikalā vai lielveikalā.
 2 Pārējos vadu galus pievienojiet zīmuļiem. Stingri piestipriniet metāla stieples skavas pie grafīta stieņiem. Jums, iespējams, vajadzēs no zīmuļiem nomizot vēl kādu koksni, lai skavas neslīdētu no grafīta stieņiem.
2 Pārējos vadu galus pievienojiet zīmuļiem. Stingri piestipriniet metāla stieples skavas pie grafīta stieņiem. Jums, iespējams, vajadzēs no zīmuļiem nomizot vēl kādu koksni, lai skavas neslīdētu no grafīta stieņiem. - Tādējādi jūs slēgsiet ķēdi, un strāva no akumulatora plūdīs pa ūdeni.
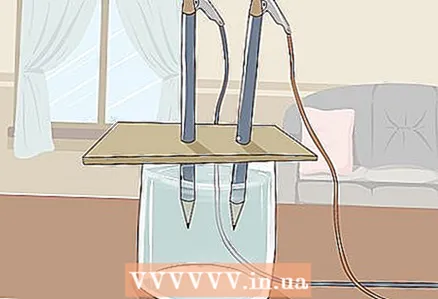 3 Novietojiet kartonu uz stikla tā, lai zīmuļu brīvie gali būtu iegremdēti ūdenī. Kartona loksnei jābūt pietiekami lielai, lai to varētu novietot uz stikla. Uzmanieties, lai netraucētu zīmuļu pareizu novietojumu.
3 Novietojiet kartonu uz stikla tā, lai zīmuļu brīvie gali būtu iegremdēti ūdenī. Kartona loksnei jābūt pietiekami lielai, lai to varētu novietot uz stikla. Uzmanieties, lai netraucētu zīmuļu pareizu novietojumu. - Lai eksperiments būtu veiksmīgs, grafīts nedrīkst pieskarties stikla sienām un apakšai. Pārbaudiet to vēlreiz un, ja nepieciešams, noregulējiet zīmuļus.
 4 Skatieties, kā ūdens sadalās ūdeņradī un skābeklī. Gāzes burbuļi sāks celties no ūdenī iegremdētiem grafīta stieņiem. Tie ir ūdeņradis un skābeklis. Ūdeņradis tiks atbrīvots negatīvajā polā un skābeklis pozitīvajā polā.
4 Skatieties, kā ūdens sadalās ūdeņradī un skābeklī. Gāzes burbuļi sāks celties no ūdenī iegremdētiem grafīta stieņiem. Tie ir ūdeņradis un skābeklis. Ūdeņradis tiks atbrīvots negatīvajā polā un skābeklis pozitīvajā polā. - Tiklīdz jūs savienojat vadus ar akumulatoru un grafīta stieņiem, caur ūdeni plūst elektriskā strāva.
- Uz zīmuļa, kas ir savienots ar negatīvo polu, veidosies vairāk gāzes burbuļu, jo katra ūdens molekula sastāv no diviem ūdeņraža atomiem un viena skābekļa atoma.
Padomi
- Ja jums nav zīmuļu ar grafīta vārpstām, tā vietā varat izmantot divus mazus vadus. Vienkārši aptiniet katra stieples vienu galu ap atbilstošo akumulatora polu un iemērciet otru ūdenī. Rezultāts būs tāds pats kā ar zīmuļiem.
- Mēģiniet izmantot citu akumulatoru. Plūstošās strāvas daudzums ir atkarīgs no akumulatora sprieguma, kas savukārt ietekmē ūdens molekulu sadalīšanās ātrumu.
Brīdinājumi
- Ja ūdenim pievienojat elektrolītu, piemēram, sāli, ņemiet vērā, ka eksperiments radīs nelielu daudzumu blakusproduktu, piemēram, hloru. Tas ir drošs tik mazos daudzumos, bet jūs varat sajust vieglu hlora smaku.
- Veiciet šo eksperimentu pieaugušo uzraudzībā. Tas ir saistīts ar elektrību un gāzēm, un tāpēc var būt bīstams, lai gan maz ticams.
Ko tev vajag
- Divi grūti mīksti zīmuļi
- Viens 6 vai 9 voltu akumulators
- Stikls ar tilpumu 350 mililitri
- 2 vadi ar krokodila skavām
- Asinātājs zīmuļiem
- Sāls