Autors:
Louise Ward
Radīšanas Datums:
11 Februāris 2021
Atjaunināšanas Datums:
1 Jūlijs 2024

Saturs
Atoma izmērs ir tik mazs, ka ir grūti precīzi noteikt ķīmiskā savienojuma atomu skaitu. Lai varētu precīzi izmērīt vielu daudzumu, zinātnieki izmanto mola vienību, lai attēlotu noteiktu atomu skaitu. Viens vielas mols ir definēts kā ekvivalents oglekļa atomu skaitam 12 gramos oglekļa izotopa, kas ir aptuveni 6022 x 10 atomi. Šo vērtību sauc par Avogadro skaitli vai Avogadro konstanti. To sauc arī par atomu skaitu 1 molā jebkura elementa, un 1 mol vielas masas sauc par šīs vielas molāro masu.
Soļi
1. metode no 2: aprēķina elementa molisko masu
Molārās masas definīcija. Vielas molārā masa ir vienas vielas mola masa (gramos). Lai aprēķinātu elementa molisko masu, reiziniet tā atomu masu ar konversijas koeficientu grami uz mol (g / mol).
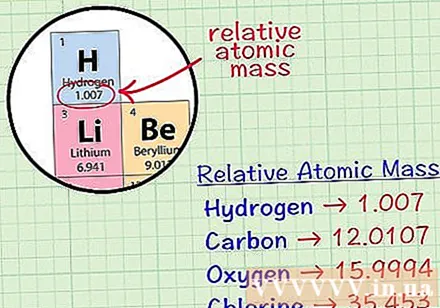
Atrodiet elementa vidējo kubisko atomu. Elementa vidējās masas atoms ir vidējā masa atomu vienībās paraugā, kas ietver visus šī elementa izotopus. Šī informācija bieži tiek sniegta periodiskajā elementu tabulā. Atrodot elementu, jūs varat atrast vidējo kubisko atomu, kas uzrakstīts tieši zem elementa ķīmiskā simbola. Šī vērtība nav vesels skaitlis, bet gan skaitlis ar decimāldaļām.- Piemēram, ūdeņradim vidējais masas atoms ir 1,007; Vidējais oglekļa kubiskais atoms ir 12,0107; Vidējais skābekļa masas atoms ir 15,9994; hlora vidējā atomu masa ir 35 453.

Reiziniet vidējās masas atomu ar molārās masas konstanti. Molārā slīdēšanas vienība ir definēta kā 0,001 kilograms uz mol vai 1 grams uz mol. Vidējās masas atoma un molārās masas konstantes reizinājums atomu masas vienību pārvērš gramos uz vienu molu, tāpēc ūdeņraža moliskā masa būs 1,007 grami uz vienu molu, ogleklis ir 12. , 0107 grami uz vienu molu, skābekļa ir 15,9995 grami uz vienu molu, bet hlora - 35 453 grami uz vienu molu.- Daži elementi dabā pastāv kā molekulas, kas sastāv no diviem vai vairākiem vienādiem atomiem. Tas ir, ja vēlaties aprēķināt savienojumu molāro masu, kas sastāv no vairāk nekā viena atoma, piemēram, ūdeņraža gāzes, skābekļa gāzes vai hlora gāzes, jums jānosaka savienojuma vidējā atoma masa un jāreizina šī vērtība. ar molārās masas konstanti '' tad '' reiziniet tikko atrasto produktu ar 2.
- Ar H2: 1007 x 2 = 2,014 grami uz vienu mol; par O2: 15,9994 x 2 = 31,9988 grami uz vienu mol; un Cl2: 35 453 x 2 = 70 096 grami uz vienu mol.
2. metode no 2: aprēķina savienojuma molāro masu

Nosaka savienojuma strukturālo formulu. Vielas strukturālā formula norāda katra elementa atomu skaitu, kas veido šo savienojumu. (Šī informācija ir pieejama visās uzziņu grāmatās). Piemēram, sālsskābes ķīmiskā formula ir HCl; glikozes ir C6H12O6. Izmantojot šo strukturālo formulu, mēs varam noteikt katra atoma veida skaitu, kas veido aplūkojamo savienojumu.- Kur HCl ir viens ūdeņraža atoms un viens hlora atoms.
- Glikozes cukura molekula C6H12O6 ir 6 oglekļa, 12 ūdeņraža un 6 skābekļa atomi.
Nosaka katra elementa vidējo masas atomu. Izmantojiet periodisko tabulu, lai atrastu katra savienojumā esošā elementa vidējo masas atomu. Vidējās masas atomu parasti raksta zem elementa ķīmiskā simbola periodiskajā tabulā. Līdzīgi kā aprēķinot elementa molisko masu, reiziniet vidējo masas atomu ar 1 gramu / mol.
- Sālsskābi veidojošo elementu vidējais masas atoms ir šāds: ūdeņradis 1,007 g / mol un hlors 35,453 g / mol.
- Glikozes molekulu veidojošo elementu vidējais masas atoms ir: ogleklis, 12,017 g / mol; ūdeņradis, 1,007 g / mol; un skābeklis, 15,9995 g / mol.
Aprēķiniet katra komponenta molāro masu. Reizinot elementa masas atomu ar atomu skaitu, kuru tas veicina savienojumā, iegūst vidējo elementa masu savienojumā.
- Sālsskābes, sālsskābes gadījumā ūdeņraža elementa molmasa ir 1,007 g / mol, hlora - 35,453 g / mol.
- Glikozes gadījumā C6H12O6, katra elementa molārā masa ir šāda: ogleklis, 12,0107 x 6 = 72,0642 g / mol; ūdeņradis, 1007 x 12 = 12,084 g / mol; skābeklis, 15,9995 x 6 = 95,9964 g / mol.
Sastāvdaļu kopējā molārā masa. Kompostēšanas elementu kopējā molārā masa ir savienojuma molārā masa.Iepriekšējā posmā mēs aprēķinājām katra savienojumā esošā elementa molāro masu, šajā posmā mums vienkārši jāpievieno visas šīs vērtības.
- Sālsskābes molārā masa ir 1,007 + 35,453 = 36,460 g / mol. 36,46 grami ir 1 mol sālsskābes masa.
- Glikozes molārā masa ir 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. Tātad katra mol glikozes masa ir 180,14 grami.
Padoms
- Lai gan vairumā gadījumu vidējais masas atoms tiek reģistrēts ar precizitāti līdz 1 daļai 1000 (4 zīmes aiz komata), laboratorijās molārā masa bieži tiek samazināta līdz 2 zīmēm aiz komata, dažreiz pat mazāk, lielām molekulām. Tāpēc laboratorijas gadījumā sālsskābes molisko masu var ierakstīt kā 36,46 gramus uz molu, glikozei - 180,14 gramus uz molu.
Ko tev vajag
- Ķīmiskās uzziņu grāmatas vai periodiskā elementu tabula
- Dators