Autors:
Judy Howell
Radīšanas Datums:
2 Jūlijs 2021
Atjaunināšanas Datums:
21 Jūnijs 2024

Saturs
Elementa atomu skaits ir protonu skaits šī elementa viena atoma kodolā. Elementa vai izotopa atomu skaits nemainās, tāpēc, lai aprēķinātu citas elementa vai izotopa īpašības, piemēram, neitronu skaitu, varat izmantot atomu numuru.
Lai soli
1. daļa no 2: atoma skaitļa atrašana
 Atrodiet periodiskās tabulas kopiju. Jūs to varat atrast šeit, ja jums nav rokas. Katram elementam ir atšķirīgs atomu skaitlis, tāpēc nav pieejamas ātras un vienkāršas metodes. Vai nu jums būs jāatrod periodiskās tabulas kopija, vai arī tā jāiegaumē.
Atrodiet periodiskās tabulas kopiju. Jūs to varat atrast šeit, ja jums nav rokas. Katram elementam ir atšķirīgs atomu skaitlis, tāpēc nav pieejamas ātras un vienkāršas metodes. Vai nu jums būs jāatrod periodiskās tabulas kopija, vai arī tā jāiegaumē. - Lielākajā daļā ķīmijas mācību grāmatu vāka iekšpusē ir iespiesta periodiskā tabula.
 Atrodiet elementu, kuru mācāties. Lielākajā daļā periodisko tabulu ir dažādu elementu pilni nosaukumi, kā arī to ķīmiskie simboli (piemēram, Hg dzīvsudrabam). Ja jums ir grūtības atrast elementu, tiešsaistē meklējiet “ķīmiskais simbols”, kam seko elementa nosaukums.
Atrodiet elementu, kuru mācāties. Lielākajā daļā periodisko tabulu ir dažādu elementu pilni nosaukumi, kā arī to ķīmiskie simboli (piemēram, Hg dzīvsudrabam). Ja jums ir grūtības atrast elementu, tiešsaistē meklējiet “ķīmiskais simbols”, kam seko elementa nosaukums.  Atrodiet atomu skaitli. Atomu skaitlis parasti atrodas lodziņa, kurā atrodas elements, augšējā kreisajā vai labajā stūrī, bet tas var atrasties arī citur lodziņā. Atomu skaitlis vienmēr ir vesels skaitlis.
Atrodiet atomu skaitli. Atomu skaitlis parasti atrodas lodziņa, kurā atrodas elements, augšējā kreisajā vai labajā stūrī, bet tas var atrasties arī citur lodziņā. Atomu skaitlis vienmēr ir vesels skaitlis. - Ja tas ir decimālskaitlis, jūs, iespējams, skatāties uz atomu masu.
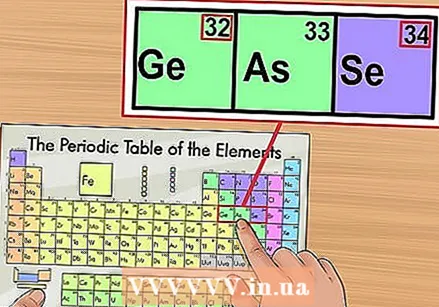 Pārbaudiet, ņemot vērā blakus esošos elementus. Periodiskā tabula ir sakārtota pēc atomu skaitļa. Ja jūsu elementa atoma skaitlis ir "33", tad kreisajā pusē esošajam elementam jābūt "32" un labajā - "34". Ja šī secība ir pareiza, jūs esat absolūti atradis atomu numuru.
Pārbaudiet, ņemot vērā blakus esošos elementus. Periodiskā tabula ir sakārtota pēc atomu skaitļa. Ja jūsu elementa atoma skaitlis ir "33", tad kreisajā pusē esošajam elementam jābūt "32" un labajā - "34". Ja šī secība ir pareiza, jūs esat absolūti atradis atomu numuru. - Aiz elementiem 56 (bārijs) un 88 (rādijs) var būt tukša vieta. Vietas patiesībā nav; elementi ar atomu numuriem, kas tur pieder, atrodas divās rindās zem pārējās sistēmas. Vienīgais iemesls, kāpēc viņi ir tik nošķirti, ir padarīt periodisko tabulu mazāk platu.
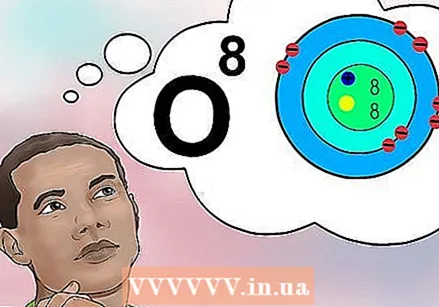 Saprotiet, kāds ir atomu skaitlis. Elementa atomu skaitam ir vienkārša definīcija: protonu skaits vienā šī elementa atomā. Šī ir elementa pamatdefinīcija. Protonu skaits nosaka kopējo kodola elektrisko lādiņu, kas nosaka, cik daudz elektronu var būt atoms. Tā kā elektroni ir atbildīgi par gandrīz visām ķīmiskajām reakcijām, atomu skaitlis netieši nosaka gandrīz visas elementa fizikālās un ķīmiskās īpašības.
Saprotiet, kāds ir atomu skaitlis. Elementa atomu skaitam ir vienkārša definīcija: protonu skaits vienā šī elementa atomā. Šī ir elementa pamatdefinīcija. Protonu skaits nosaka kopējo kodola elektrisko lādiņu, kas nosaka, cik daudz elektronu var būt atoms. Tā kā elektroni ir atbildīgi par gandrīz visām ķīmiskajām reakcijām, atomu skaitlis netieši nosaka gandrīz visas elementa fizikālās un ķīmiskās īpašības. - Citādi sakot, katrs atoms ar astoņiem protoniem ir skābekļa atoms. Diviem skābekļa atomiem var būt atšķirīgs neitronu skaits vai (ja viens ir jons) atšķirīgs elektronu skaits, taču abos vienmēr būs astoņi protoni.
2. daļa no 2: saistītās informācijas atrašana
 Atomu svara atrašana. Atomu svars parasti tiek uzdrukāts zem attiecīgā elementa nosaukuma periodiskajā tabulā un parasti tiek aprēķināts precīzi līdz divām vai trim zīmēm aiz komata. Šī ir viena atoma vidējā elementa masa, kas pielāgota tam, ko jūs, iespējams, atradīsit dabā. Šis skaitlis ir "atomu masas vienībās" (AMU (no angļu valodas "atomic mass unit")).
Atomu svara atrašana. Atomu svars parasti tiek uzdrukāts zem attiecīgā elementa nosaukuma periodiskajā tabulā un parasti tiek aprēķināts precīzi līdz divām vai trim zīmēm aiz komata. Šī ir viena atoma vidējā elementa masa, kas pielāgota tam, ko jūs, iespējams, atradīsit dabā. Šis skaitlis ir "atomu masas vienībās" (AMU (no angļu valodas "atomic mass unit")). - Daži zinātnieki termina "atomu masa" vietā lieto terminu "relatīvā atomu masa".
 Izprotiet atomu masu. Atomu masa ir jēdziens, kas ir ļoti līdzīgs atomu svaram. Vienīgā atšķirība ir tā, ka jūs runājat par noteiktu atomu, nevis testa parauga vidējo. Gramas dzelzs satur daudz atomu ar masām, kas nedaudz atšķiras viena no otras, tāpēc, lai atrastu vidējo, jūs meklējat "relatīvo svaru". Ja jūs interesē tikai viens konkrēts dzelzs atoms, jums nav svarīgs vidējais rādītājs - jūs interesē tikai precīza šī konkrētā atoma masa.
Izprotiet atomu masu. Atomu masa ir jēdziens, kas ir ļoti līdzīgs atomu svaram. Vienīgā atšķirība ir tā, ka jūs runājat par noteiktu atomu, nevis testa parauga vidējo. Gramas dzelzs satur daudz atomu ar masām, kas nedaudz atšķiras viena no otras, tāpēc, lai atrastu vidējo, jūs meklējat "relatīvo svaru". Ja jūs interesē tikai viens konkrēts dzelzs atoms, jums nav svarīgs vidējais rādītājs - jūs interesē tikai precīza šī konkrētā atoma masa. - Praksē atomu masu parasti jau piešķir ķīmijas problēmām, kas attiecas tikai uz vienu atomu. Izprotiet šo jēdzienu, lai jūs nebrīnītos, ja tas atšķiras no atomu svara.
 Noapaļo līdz masas skaitlim. Masas numurs ir kopējais protonu un neitronu skaits vienā elementa atomā. Jūs varat viegli atrast šo skaitli: vienkārši paņemiet atomu svaru, kas norādīts periodiskajā tabulā, un noapaļojiet līdz tuvākajam veselajam skaitlim.
Noapaļo līdz masas skaitlim. Masas numurs ir kopējais protonu un neitronu skaits vienā elementa atomā. Jūs varat viegli atrast šo skaitli: vienkārši paņemiet atomu svaru, kas norādīts periodiskajā tabulā, un noapaļojiet līdz tuvākajam veselajam skaitlim. - Tas darbojas, jo neitroni un protoni ir aptuveni 1 AMU un elektroni ir tuvu 0 AMU. Lai iegūtu decimālo skaitli, tiek izmantoti precīzi mērījumi atoma svaram, taču mūs interesē tikai veseli skaitļi, kas mums norāda protonu un neitronu skaitu.
- Atcerieties, ka, izmantojot atomu svaru, iegūsiet tipiska parauga vidējo vērtību. Broma parauga masas numurs ir aptuveni 80, bet, kā redzams, viena broma atoma masas numurs gandrīz vienmēr ir 79 vai 81.
 Aprēķiniet neitronu skaitu. Tagad jūs zināt, ka atomu skaitlis = protonu skaits un ka masas skaitlis = protonu skaits + neitronu skaits. Lai uzzinātu, cik daudz neitronu ir elementā, no masas skaitļa jāatņem atomu skaitlis. Šeit ir daži piemēri:
Aprēķiniet neitronu skaitu. Tagad jūs zināt, ka atomu skaitlis = protonu skaits un ka masas skaitlis = protonu skaits + neitronu skaits. Lai uzzinātu, cik daudz neitronu ir elementā, no masas skaitļa jāatņem atomu skaitlis. Šeit ir daži piemēri: - Viena hēlija atoma (He) masas skaitlis ir 4 un atomu skaitlis 2. Tāpēc tam jābūt 4 - 2 = 2 neitroni piederēt.
- Sudraba parauga (Ag) masas numurs ir aptuveni 108 (saskaņā ar periodisko tabulu) un atomu skaitlis 47. Vidēji katram sudraba atomam paraugā ir 108 - 47 = 61 neitroni.
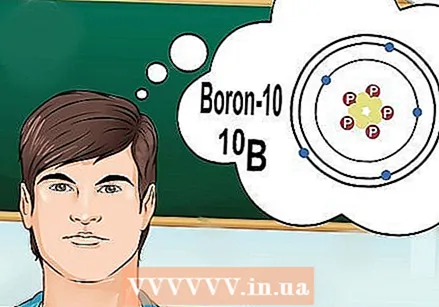 Saprast, kas ir izotopi. Izotops ir noteikta elementa forma ar noteiktu neitronu skaitu. Ja ķīmijas jautājums attiecas uz "bors-10" vai "B", tie attiecas uz bora elementu ar masas skaitli 10. Izmantojiet šo masas numuru "tipiskās" bora vērtības vietā.
Saprast, kas ir izotopi. Izotops ir noteikta elementa forma ar noteiktu neitronu skaitu. Ja ķīmijas jautājums attiecas uz "bors-10" vai "B", tie attiecas uz bora elementu ar masas skaitli 10. Izmantojiet šo masas numuru "tipiskās" bora vērtības vietā. - Izotopiem nav atšķirīga atomu skaitļa. Katram elementa izotopam ir vienāds protonu skaits.
Padomi
- Dažiem smagākiem elementiem ir atomu svars, kas ir iekavās vai iekavās. Tas nozīmē, ka atomu svars ir precīzākā stabilākā izotopa masa, nevis vairāku izotopu vidējā vērtība. (Tas neietekmē elementa atomu skaitu.)



