Autors:
Lewis Jackson
Radīšanas Datums:
5 Maijs 2021
Atjaunināšanas Datums:
1 Jūlijs 2024

Saturs
Mol ir standarta mērvienība ķīmijā, ko izmanto, lai apskatītu dažādus savienojuma elementus. Parasti savienojuma masu aprēķina gramos (g), un tā jāpārvērš molārajās vienībās. Pāreja ir diezgan vienkārša, tomēr joprojām ir daži svarīgi soļi, kas mums jāievēro. Izmantojot zemāk esošo metodi, jūs varat viegli konvertēt gramus uz molu.
Soļi
1. daļa no 2: Aprēķiniet molekulmasu
Sagatavojiet nepieciešamos materiālus matemātikas uzdevuma risināšanai. Kad jums būs pieejami visi rīki, problēmu būs vieglāk atrisināt. Jums ir nepieciešams:
- Zīmulis un papīrs. Matemātika kļūst vieglāka, kad visu pierakstāt uz papīra. Lai sasniegtu maksimālo punktu skaitu, jums jāuzrāda visas darbības.
- Ķīmisko elementu periodiskā tabula: izmanto, lai noteiktu elementu masas atomus.
- Kabatas kalkulators: izmanto, lai aprēķinātu sarežģītus skaitļus.

Nosakiet, kuri elementi ir savienojumā, kas jāpārvērš molārajās vienībās. Molekulmasas aprēķināšanas pirmais solis ir elementu noteikšana, kas veido savienojumu. Tas ir viegli, jo elementu saīsinājums ir tikai viena līdz divas rakstzīmes.- Ja viela ir saīsināta ar divām rakstzīmēm, pirmais burts ir lielais un otrais burts ir mazais. Piemērs: Mg ir magnija elementa saīsinājums.
- NaHCO savienojumi3 sastāv no četriem elementiem: nātrijs (Na), ūdeņradis (H), ogleklis (C) un skābeklis (O).
Nosakiet atomu skaitu katram savienojuma elementam. Lai aprēķinātu šī savienojuma masas molekulu, jums jāzina katras savienojuma vielas atomu skaits. Mazais skaitlis blakus elementa saīsinājumam apzīmē elementa atomu numuru.- Piemērs: savienojums H2O ir divi ūdeņraža atomi un viens skābekļa atoms.
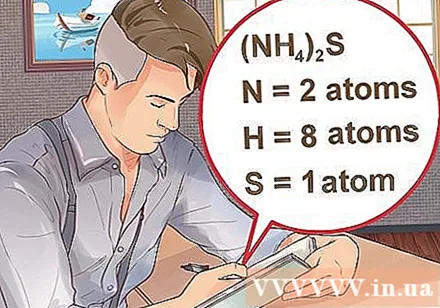
- Ja savienojums ir ierakstīts iekavās, pievienojot nelielu indeksu, tas nozīmē, ka katra iekavās esošā sastāvdaļa indeksu reizina. Piemērs: savienojums (NH4)2S sastāv no diviem N atomiem, astoņiem H atomiem un viena S atoma.

Pierakstiet kubisko atomu papīru katram elementam. Periodiskās tabulas izmantošana ir vienkāršākais veids, kā atrast elementa kubisko atomu. Pēc elementa atrašanas periodiskajā tabulā jūs redzēsiet atomu masu tieši zem elementa ikonas.- Piemēram, skābekļa kubiskais atoms ir 15,99.
Aprēķiniet molekulmasu. Vielas masas molekula ir vienāda ar katra elementa atomu skaitu, kas reizināts ar šī elementa masas atomu. Šis daudzums ir būtisks, pārrēķinot gramos uz moliem.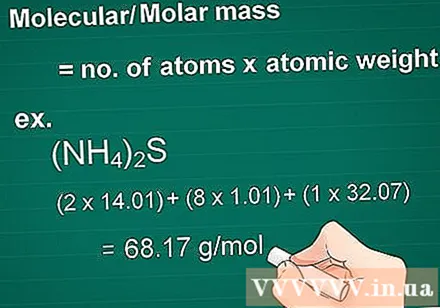
- Vispirms reiziniet katra savienojuma elementa atomu skaitu ar tā masas atomu.
- Tad kopā pievienojiet elementu masas savienojumā.
- Piemērs: Savienojuma (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mol.
- Molekulmasu sauc arī par molmasu.
2. daļa no 2: Konvertējiet gramus uz mol
Iestatiet reklāmguvumu formulu. Lai uzzinātu savienojuma molu skaitu, daliet savienojuma gramu skaitu ar šī savienojuma molāro masu.
- Formula: molu skaits = masa (grami) / savienojuma molārā masa (grami / mol)
Formulā aizstājiet skaitļus. Pēc pareizās formulas iestatīšanas nākamais solis ir aprēķināto skaitļu aizstāšana formulā. Ja vēlaties pārliecināties, vai dati atrodas pareizajā pozīcijā, varat tos pārbaudīt, nomācot vienību. Ja pēc vienkāršības atlikusī vienība ir moli, tad jūs esat pareizi iestatīts.
Atrisiniet vienādojumu. Izmantojot kalkulatoru, masu sadala ar vielas vai savienojuma kubisko molekulu. Dalījums būs meklētās vielas vai savienojuma molu skaits.
- Piemēram, problēma ir ar 2 g ūdens (H2O) un lūgt to pārvērst molārajās vienībās. Mums ir H molārā masa2O ir 18 g / mol. Sadaliet 2 ar 18, tāpēc jums ir 0,1111 mol H2O.
Padoms
- Neaizmirstiet iekļaut atbildēs elementa vai salikto nosaukumu.
- Ja jums tiek lūgts uzrādīt vingrinājumu vai viktorīnu, noteikti skaidri parādiet savas atbildes, riņķojot vai uzzīmējot rūtiņu ap atbildēm.
Ko tev vajag
- Ķīmiskā periodiskā tabula
- Zīmulis
- Papīrs
- Dators
- Ķīmijas problēmas